BAB I
PENDAHULUAN
1.1
Latar
Belakang
Sejak
pertengahan abad ke-20 ini, peranan bahan tambahan pangan (BTP) khususnya bahan
pengawet menjadi semakin penting sejalan dengan kemajuan teknologi produksi
bahan tambahan pangan sintetis. Banyaknya bahan tambahan pangan dalam bentuk
lebih murni dan tersedia secara komersil dengan harga yang relatif murah akan
mendorong meningkatnya pemakaian bahan tambahan pangan yang berarti
meningkatnya konsumsi bahan tersebut bagi setiap individu. Pengertian bahan
tambahan pangan dalam Peraturan Menteri Kesehatan RI secara umum adalah bahan
yang biasanya tidak digunakan sebagai makanan dan biasanya bukan merupakan
komponen khas makanan, mempunyai atau tidak mempunyai nilai gizi, yang dengan
sengaja ditambahkan ke dalam makanan untuk maksud teknologi pada pembuatan
pengolahan, penyimpanan, perlakuan, pengepakan, pengemasan dan penyimpanan.
Tujuan penggunaan bahan tambahan pangan ini sendiri yaitu dapat meningkatkan
atau mempertahankan nilai gizi dan kualitas daya simpan, membuat bahan pangan
lebih mudah dihidangkan, serta mempermudah preparasi bahan pangan (Cahyadi, 2008).
Bahan
tambahan makanan yang digunakan untuk menjaga kualitas makanan tersebut salah
satunya adalah zat pengawet. Bahan pengawet umumnya digunakan untuk mengawetkan
makanan yang mempunyai sifat mudah rusak. Bahan ini dapat menghambat atau
memperlambat proses fermentasi, pengasaman, atau penguraian yang disebabkan
oleh mikroba. Akan tetapi, tidak jarang produsen menggunakannya pada pangan
yang relatif awet dengan tujuan untuk memperpanjang masa simpan atau
memperbaiki tekstur (Cahyadi,
2008). Menurut Hermana (1991), pengawetan dengan zat kimia merupakan teknik
yang relatif sederhana dan murah. Cara ini terutama bermanfaat bagi wilayah
yang tidak mudah menyediakan sarana penyimpanan pada suhu rendah. Konsentrasi
bahan pengawet yang diizinkan oleh peraturan sifatnya adalah penghambatan dan
bukannya mematikan organisme-organisme pencemar, oleh karena itu populasi
mikroba dari bahan pangan yang akan diawetkan harus dipertahankan seminimum
mungkin dengan cara penanganan dan pengolahan secara higienis. Bahan kimia
berbahaya yang bukan ditujukan untuk makanan, justru ditambahkan ke dalam
makanan misalnya boraks akan sangat membahayakan konsumen (Yuliarti, 2009).
Tingkat
pengetahuan yang rendah mengenai bahan pengawet merupakan faktor utama penyebab
penggunaan boraks pada produk makanan. Beberapa survei menunjukkan, alasan
produsen menggunakan boraks sebagai bahan pengawet karena daya awet dan mutu
yang dihasilkan menjadi lebih bagus, serta murah harganya, tanpa peduli bahaya
yang dapat ditimbulkan. Hal
tersebut juga ditunjang
oleh perilaku konsumen yang
cenderung untuk membeli
makanan yang harga
murah tanpa mengutamakan kualitas
sehingga penggunaan bahan
tambahan pangan dianggap sebagai hal biasa. Sulitnya
membedakan produk yang dibuat dengan penambahan boraks juga menjadi salah satu
faktor pendorong perilaku konsumen tersebut (Cahyadi, 2008).
Perlu
dilakukan upaya peningkatan kesadaran dan pengetahuan bagi produsen dan
konsumen tentang bahaya pemakaian bahan kimia yang bukan termasuk dalam
katagori bahan tambahan pangan.
Sikap pemerintah yang
lebih tegas juga
diperlukan untuk melarang
penggunaan bahan-bahan kimia berbahaya pada produk pangan karena dapat
menimbulkan keracunan dan kematian (Cahyadi, 2008).
Berdasarkan
masalah yang terjadi di atas, maka dilakukan percobaan pembuatan indikator bahan
alami untuk uji borak. Prinsip
indikator alami ini adalah bahan yang memberikan warna berbeda pada setiap lingkungan
asam basa. Indikator alami yang diperoleh dari zat
warna tumbuh-tumbuhan khususnya bagian bunga mempunyai sifat spesifik yaitu
mempunyai trayek pH tetentu, mempunyai tingkat kecermatan dan keakuratan
tertentu. Sifat ini dipengaruhi oleh cara ekstraksi dan preparasinya. Kajian
ini akan meninjau dari senyawa zat warna alami, bahan pengekstrak, metode
maserasi dan preparasinya agar dapat digunakan sebagai indikator uji borak
(Siti, 2012). Indikator dari bahan alami ini akan sedikit memudahkan
masyarakat luas untuk mengidentifikasi adanya bahan pengawet borak yang
dilarang dalam makanan. Masyarakat tidak perlu bersusah payah mencari bahan
kimia ataupun alat identifikasi borak, karena sebenarnya mereka bisa
memanfaatkan tumbuhan alam disekitar mereka.
Adapun
keunggulan pemanfaatan bahan alam sebagai indikator uji boraks ini yaitu sederhana,
mudah didapat dan murah.
1.2 Rumusan Masalah
Berdasarkan uraian latar belakang terdapat dua permasalahan
sebagai berikut:
1.
Bahan alami apa saja yang dapat dimanfaatkan sebagai indikator borak?
2.
Bagaimana perbandingan uji borak
dengan indikator konvensional dan
indikator alam?
1.3 Tujuan
Adapun tujuan dari analisis indikator alam sebagai
uji boraks adalah sebagai
berikut:
1.
Dapat mengetahui apa saja bahan alami yang dapat dimanfaatkan sebagai indikator borak
2.
Mampu membandingkan pengujian borak dengan indikator konvensional dan indikator alam
1.4 Manfaat
Manfaat yang dapat diambil dari pemanfaatan
bahan alam sebagai indikator boraks adalah:
1.
Bagi Mahasiswa
a. Memberi
pengetahuan tentang apa saja bahan alam yang bisa digunakan sebagai indikator
borak, sehingga diharapkan dapat diaplikasikan dalam kehidupan sehari-hari
b. Menambah
wawasan, pengetahuan dan keterampilan sesuai dengan teori-teori yang telah
diperoleh di bangku kuliah
2. Bagi
Masyarakat
Dapat memudahkan masyarakat dalam identifikasi bahan
pengawet yang
dilarang dalam makanan secara sederhana dan efisien menggunakan
indikator alami
3.
Bagi Peneliti
Untuk
menindaklanjuti praktikum yang telah dilakukan ini terkait dengan pemanfaatan bahan alam sebagai indikator borak.
BAB II
DASAR TEORI
2.1 Bahan Tambahan Pangan
Bahan tambahan pangan
(BTP) adalah bahan
atau campuran bahan
yang secara alami
bukan merupakan bagian
dari bahan baku
pangan, tetapi ditambahkan ke dalam pangan untuk mempengaruhi
sifat atau bentuk
bahan pangan. BTP ditambahkan untuk memperbaiki
karakter pangan agar kualitasnya meningkat. Pemakaian BTP merupakan salah
satu langkah teknologi
yang diterapkan oleh
industri pangan berbagai skala.
Sebagaimana langkah teknologi lain, maka resiko-resiko kesalahan
dan penyalahgunaan tidak
dapat dikesampingkan. Bahan tambahan pangan pada umumnya merupakan
bahan kimia yang telah diteliti
dan diuji lama sesuai dengan
kaidah – kaidah ilmiah yang ada. Pemerintah telah mengeluarkan aturan-aturan
pemakaian BTP secara optimal
(Cahyadi, 2008).
2.1.1 Bahan Tambahan
Pangan
yang diizinkan
Penggolongan BTP yang diizinkan
digunakan pada pangan menurut
Peraturan Menteri Kesehatan RI nomor 722
tahun 1988 adalah sebagai berikut :
1.
Pewarna, yaitu
BTP yang dapat memperbaiki
atau memberi warna
pada pangan.
2.
Pemanis
buatan, yaitu BTP yang dapat
menyebabkan rasa manis pada pangan, yang tidak atau
hampir tidak mempunyai
nilai gizi.
3.
Pengawet, yaitu
BTP yang dapat mencegah
atau menghambat fermentasi,
pengasaman atau
peruaian lain pada ccm pangan yang disebabkan oleh pertumbuhan mikroba.
4.
Antioksida,
yaitu BTP yang dapat mencegah
atau menghambat proses oksidasi lemak sehingga mencegah
terjadinya ketengikan.
5.
Anti
kempal, yaitu BTP yang dapat
mencegah mengempalnya (menggumpalnya) pangan yang berupa
serbuk seperti tepung
atau bubuk.
6.
Penyedap rasa
dan aroma, menguatkan rasa, yaitu BTP yang dapat memberikan, menambah atau mempertegas rasa aroma.
7.
Pengatur
keasaman (pengasam, penetral
dan pendapar) yaitu BTP yang dapat mengasamkan, menetralkan dan mempertahankan derajat
keasaman pangan.
8.
Pemutih
dan pematang tepung,
yaitu BTP yang dapat mempercepat
proses pemutihan dan
atau pematang tepung
sehingga dapat memperbaiki mutu pemanggangan.
9.
Pengemulsi,
pemantap
dan pengental yaitu
BTP yang dapat membantu
terbentuknya dan memantapkan system
dipersi yang homogen pada
pangan.
10. Pengeras, yaitu BTP yang dapat
memperkeras atau mencegah melunaknya
pangan.
11. Sekuestran, yaitu BTP yang dapat
mengikat ion logam yang ada
dalam pangan, sehingga memantapkan
warna, aroma dan tekstrur.
2.1.2 Bahan Tambahan Pangan
yang dilarang
Beberapa
bahan tambahan yang dilarang dalam makanan menurut Peraturan Menteri Kesehatan
RI sebagai berikut ini.
1. Natrium
tetraborat (borak)
2. Formalin
(formaldehyd)
3. Minyak
nabati yang dibrominasi (brominanted
vegetable oils)
4. Kloramfenikol
(chlorampenicol)
5. Kalium
klorat (pottasium chlorate)
6. Dietilpirokarbonat
(dietylpyrocarbonate, DEPC)
7. Nitrofuranzon
(nitrofuranzone)
8.
P-Phenetilkarbamida (p-phenethylcarbamide, dulcin,
4-ethoxyphenyl urea)
9. Asam
salisilat dan garamnya (salicylic acid
and its salt)
Namun,
selain bahan tambahan pangan di atas masih ada tambahan kimia yang dilarang,
seperti rhodamin B (pewarna merah), methanyl
yellow (pewarna kuning), dulsin (pemanis sintetis) dan potasium bromat
(pengeras).
2.2 Zat Pengawet
Peranan
bahan tambahan pangan (BTP) khususnya bahan pengawet menjadi semakin penting
sejalan dengan kemajuan teknologi produksi BTP sintesis. Banyaknya BTP dalam
bentuk lebih murni dan tersedia secara komersil dengan harga yang relatif murah
akan mendorong meningkatnya pemakaian BTP yang berarti meningkatkan konsumsi
bahan tersebut bagi setiap individu (Cahyadi, 2008). Meningkatnya pertumbuhan
industri makanan di Indonesia, telah terjadi peningkatan produksi makanan yang beredar di masyarakat. Zat
pengawet terdiri dari zat pengawet organik dan anorganik dalam bentuk asam dan
garamnya.
1.2.1
Zat
pengawet organik
Zat
pengawet organik lebih banyak dipakai daripada anorganik karena bahan ini lebih
mudah dibuat. Zat kimia yang sering dipakai sebagai bahan pengawet ialah asam
sorbat, asam propionat, asam benzoat, asam asetat, dan epoksida. Asam askorbat
terutama digunakan untuk mencegah pertumbuhan kapang dan bakteri dengan jalan
mencegah kerja enzim dehidrogenase terhadap asam lemak. Struktur α-diena pada
asam sorbat dapat mencegah oksidasi asam lemak. Sorbat aktif pada pH di atas 6,5
dan keaktifannya menurun dengan meningkatnya pH. Bentuk yang digunakan umumnya
adalah garam Natrium dan Kalium sorbat. Asam propionat (CH3CH2COOH)
dengan struktur yang terdiri tiga atom karbon tidak dapat dimetabolime mikroba.
Garam propionat yang digunakan adalah garam natrium dan kalsiumnya, dan bentuk
efektifnya adalah bentuk molekul tidak terdisosiasi (Cahyadi, 2008).
Propionat
efektif terhadap kapang dan beberapa khamir pada pH di atas 5. Asam benzoat (C6H5COOH)
digunakan untuk mencegah pertumbuhan kamir dan bakteri (efektif pH 2.4 – 4.0). Kelarutan
garam tersebut lebih besar, maka yang biasa digunakan adalah bentuk garam Natrium benzoat. Sedangkan
dalam bahan, garam benzoat terurai menjadi bentuk efektif yaitu bentuk asam
benzoat yang tak terdisosiasi. Asam benzoat secara alami terdapat pada cengkeh
dan kayu manis. Tubuh
mengalami mekanisme
detoksifikasi terhadap asam benzoat, sehingga tidak terjadi penumpukan asam
benzoat (Cahyadi,
2008).
1.2.2
Zat
Pengawet Anorganik
Zat
pengawet anorganik yang masih sering dipakai adalah sulfit, nitrat, dan nitrit.
Sulfit digunakan dalam bentuk gas SO2, garam Na, atau K – sulfit,
bisulfit dan metabisulfit. Bentuk efektifnya sebagai pengawet adalah asam
sulfit tak terdisosiasi (terutama terbentuk pada pH di bawah 3). Molekul sulfit
mudah menembus dinding sel mikroba bereaksi dengan asetaldehida membentuk
senyawa yang tidak dapat difermentasi mikroba, mereduksi ikatan disulfida
enzim, dan bereaksi dengan keton membentuk hidrosisulfonat yang dapat
menghambat mekanisme pernafasan. Sulfit juga dapat bereaksi dengan gugus
karbonil dan hasilnya mengikat melanoidin sehingga mencegah timbulnya warna
coklat. Sulfur dioksida juga dapat berfungsi sebagai antioksidan dan
meningkatkan daya kembang terigu (Cahyadi,
2008).
2.3 Natrium Tetraborat
( Borak )
Boraks
adalah senyawa berbentuk kristal putih tidak berbau dan stabil pada suhu dan
tekanan normal. Borak merupakan senyawa kimia dengan nama natrium tetraborat
(Na2B4O7). Jika larut dalam air akan
menjadi hidroksida dan asam borat (H3BO3). Boraks atau
asam borak biasanya digunakan untuk bahan pembuat deterjen, mengurangi
kesadarahan air dan antiseptik (Wardayati,
2012). Adapun struktur dari borak yaitu:
Sudah
tidak asing lagi bahwa banyak zat-zat berbahaya yang langsung dicampur sebagai
bahan tambahan makanan, salah satu zat yang sering digunakan yaitu ‘borak’ atau
‘bleng’. Borak bersifat
desinfektan yang digunakan
sebagai pengawet kayu
(Vogel, 1985). Borak sering
disalahgunakan sebagai bahan
penambahan makanan,
penambahan senyawa borak
berfungsi untuk memperbaiki
tekstur makanan sehingga menghasilkan tekstur
yang kenyal dan
mengkilat. Konsumsi borak
dalam jumLah yang sedikit pada
jangka panjang memberikan
dampak serius bagi
tubuh, mulai dari gangguan
pencernaan, ganguan syaraf,
anemia, kerontokan rambut
hingga meningkatkan resiko terjadinya
kanker (bersifat karsinogen).
Menurut Peraturan Menteri
Kesehatan nomor 722
tentang bahan tambahan makanan, borak
termasuk bahan yang
berbahaya dan beracun
sehingga tidak boleh
digunakan sebagai bahan tambahan makanan (Cahyadi, 2008).
Teridentifikasinya
borak pada makanan-makanan tersebut dapat kita rasakan pula perbedaannya dengan
makanan yang tidak menggunakan borak. Boraks beracun terhadap semua sel, bila
tertelan borak dapat mengakibatkan efek pada susunan syaraf pusat, ginjal dan
hati. Konsentrasi tertinggi dicapai selama ekskresi. Ginjal merupakan organ
paling mengalami kerusakkan dibandingkan dengan orang lain. Dosis fatal untuk
dewasa yaitu 15 - 20 gram, sedangkan
untuk anak-anak 3 - 6 gram. Pemerintah telah
memperbolehkan penggunaan boraks sebagai bahan makanan, namun dibatasi oleh UU
Kesehatan dan Keselamatan Nasional, batasnya hanya 1 gram per 1 kilogram
pangan, bila lebih, itu ilegal, pelaku akan dipajara 12 tahun bila menambahkan
lebih dari 1 gram per 1 kilogram pangan (Depkes, 2000). Dalam dunia industri,
boraks menjadi :
a. bahan
solder,
b. bahan
pembersih,
c. pengawet
kayu,
d. antiseptik
kayu,
e. dan
pengontrol kecoak.
2.4 Titrasi Asam-Basa
Titrasi
asan basa merupakan metode analisis kimia konvensional yang digunakan untuk
menentukan konsentrasi asam maupun basa. Sampai saat ini metode titrasi masih
digunakan walaupun telah berkembang metode-metode lain dengan menggunakan
instrumen tertentu karena metode titrasi merupakan metode yang cukup sederhana,
mudah, murah dan aman jika diaplikasikan pada makanan.
Titrasi
asam basa didasarkan pada titik ekuivalen antara asam dan basa. Titik ekuivalen
biasanya ditentukan dengan titik akhir titrasi yaitu pada saat konsentrasi asam
ekuivalen dengan konsentrasi basanya. Titik akhir titrasi ditandai dengan
penambahan substansi ke dalam larutan analit sehingga terjadi perubahan warna
setelah titik ekuivalen terjadi. Substansi yang ditambahkan ke dalam analit
tersebut disebut sebagai indikator (Marwati, 2012).
Indikator
titrasi asam basa adalah zat-zat warna yang warnanya bergantung pada pH
larutan, atau zat yang dapat menunjukkan
sifat asam, basa dan netral. Sebagai contoh
kertas lakmus merah atau biru, berwarna merah dalam larutan
yang pHnya lebih kecil dari
5,5 dan berwarna
biru dalam larutan yang pHnya
lebih besar dari 8. Larutan
yang memiliki pH 5,5 – 8, warna lakmus adalah
kombinasi wana merah
dan biru. Batas-batas
pH saat indikator mengalami
perubahan warna disebut trayek indikator
Indikator
yang sering digunakan dalam titrasi asam basa adalah indikator phenolptalin (pp) dan indikator
metil orange (mo).
Indikator-indikator ini merupakan indikator kimiawi dan dijual di pasaran
dengan harga yang relatif mahal. Masih banyak indikator kimiawi yang telah
digunakan untuk titrasi asam basa yang disesuaikan dengan trayek pH dari
indikator tersebut. Selain indikator komersial, telah ditemukan indikator dari
bahan alami misalnya dari bunga mawar (Catharantus
roseus) (Kokil, 2006), bunga pukul empat (Miriabillis yalapa), bunga kana (Canna indica) (Shishir, dkk, 2008), bunga rosella (Hibiscus sabdariffa) dan bayam merah (Bisella alba) (Izonfuo, 2006). Hampir
semua tumbuhan yang menghasilkan warna dapat digunakan sebagai indikator karena
dapat berubah warna pada suasana asam dan basa walaupun kadang-kadang perubahan
warna tersebut kurang jelas atau hampir mirip untuk perubahan pH tertentu. Masing-masing
bunga penghasil warna mempunyai sifat spesifik pada penggunaannya sebagai
indikator alami. Sifat-sifat tersebut antara lain mempunyai trayek pH yang
spesifik, dalam bentuk larutan tidak tahan lama, mudah rusak dan berbau tidak
sedap serta mempunyai kecermatan dan keakuratan tertentu pada titrasi asam basa
tertentu.
Berdasarkan
uraian di atas maka hasil praktikum mandiri ini akan mengulas permasalahan dari
aplikasi beberapa ekstrak bunga berwarna sebagai indikator alami pada
titrasi asam basa yang ditinjau dari
kecermatan dan keakuratannya jika dibandingkan dengan indikator kimiawi seperti
indikator pp dan mo. Jika tingkat kecermatan dan keakuratan indikator alami
yang diaplikasikan pada titrasi asam basa diketahui maka diharapkan dapat
memilih indikator alami dari ekstrak bunga berwarna tertentu untuk titrasi asam
basa tertentu dengan tingkat kecermatan dan keakuratan yang tinggi.
2.5 Indikator buatan
dan indikator alam
Senyawa asam mempunyai rasa asam, sedangkan
senyawa basa mempunyai rasa pahit. Namun begitu, tidak dianjurkan untuk
mengenali asam dan basa dengan cara mencicipinya, sebab banyak diantaranya yang
dapat merusak kulit (korosif) atau bahkan bersifat racun. Asam dan basa dapat
dikenali dengan menggunakan zat indikator, yaitu zat yang memberi warna berbeda
dalam lingkungan asam dan lingkungan basa (zat yang warnanya dapat berubah saat
berinteraksi atau bereaksi dengan senyawa asam maupun senyawa basa). Dalam
laboratorium kimia, indikator asam-basa yang biasa di gunakan ada 2 yaitu indikator
alam dan indikator buatan.
2.5.1 Indikator Buatan
Indikator
buatan adalah indikator siap pakai yang sudah dibuat di laboratorium
atau pabrik alat-alat kimia. Contoh indikator buatan adalah kertas lakmus,
yang terdiri dari lakmus merah dan lakmus biru, indikator universal,
fenolptalin, dan metal jingga. Asam,
basa, dan garam dapat
diidentifikasi menggunakan kertas lakmus. Kertas
lakmus merah di dalam larutan asam akan tetap merah, di dalam larutan basa akan
berwarna biru. Indikator universal, fenolptalin, dan metil jingga
selain dapat mengidentifikasi sifat larutan asam basa juga dapat digunakan
untuk menentukan derajat keasaman (pH) larutan.
2.5.2 Indikator Alam
Indikator
alami berasal dari bahan organik. Indikator alami merupakan bahan-bahan alam
yang dapat berubah warnanya dalam larutan asam,basa, dan netral, namun tidak bisa
menunjukkan nilai pH-nya. Indikator alam yang biasanya dilakukan dalam
pengujian asam basa adalah tumbuhan yang berwarna mencolok, berupa
bunga-bungaan, umbi-umbian, kulit buah, dan dedaunan. Perubahan warna indikator
bergantung pada warna jenis tanamannya, misalnya kembang sepatu merah di dalam
larutan asam akan berwarna merah dan di dalam larutan basaakan berwarna hijau,
kol ungu di dalam larutan asam akan berwarna merah keunguan dan di dalam
larutan basa akan berwarna hijau. Contoh indikator alami
yaitu, ekstrak bunga
sepatu, ekstrak bunga mawar, kunyit
dan lain-lain.
2.6 Ekstraksi
Ekstraksi
adalah suatu cara untuk menarik satu atau lebih zat dari bahan asal dengan
menggunakan pelarut (Syamsuni, 2006). Zat aktif yang terdapat dalam simplisia
tersebut dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid
dan lain-lain (Depkes, 2000). Tujuan utama ekstraksi ini adalah untuk
mendapatkan atau memisahkan sebanyak mungkin zat-zat yang memiliki khasiat
pengobatan (Syamsuni, 2006).
Metode
ekstraksi dengan menggunakan
pelarut
dapat dilakukan dengan beberapa cara (Depkes, 2000) yaitu :
2.6.1 Tanpa
pemanasan
1. Maserasi
Maserasi
berasal dari kata macerare artinya
melunakkan. Maserat adalah hasil penarikan simplisia dengan cara maserasi,
sedangkan maserasi adalah penarikan cara penarikan simplisia dengan merendam simplisia
tersebut dalam cairan penyari (Syamsuni, 2006) dengan beberapa kali pengocokan
atau pengadukan pada temperatur kamar, sedangkan remaserasi merupakan
pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama,
dan seterusnya. Keuntungan dari metode maserasi yaitu prosedur dan peralatannya
sederhana. Sedangkan untuk
kerugiannya, metode maserasi ini pengerjannya lama karena harus dilakukan
selama 24 jam
(Depkes, 2000).
2. Perkolasi
Perkolasi adalah suatu cara
penarikan memakai alat yang disebut perkolator dimana simplisia terendam dalam
cairan penyari, zat-zat akan
terlarut
dan larutan tersebut akan menetes secara beraturan (Syamsuni, 2006). Prosesnya
terdiri dari tahapan pengembangan bahan, tahap perendaman antara, tahap
perkolasi sebenarnya (penetesan atau penampungan
perkolat) sampai diperoleh ekstrak (Depkes, 2000). Keuntungan dari metode
perkolasi ini adalah proses penarikan zat berkhasiat dari tumbuhan lebih
sempurna, sedangkan kerugiannya adalah membutuhkan waktu yang lama dan
peralatan yang digunakan mahal (Agoes, 2007).
2.6.2 Menggunakan
pemanasan
1.
Refluks
Refluks
adalah ekstraksi dengan pelarut pada temperatur titik didihnya, selama waktu
tertentu dan pelarut akan terdestilasi menuju pendingin dan akan kembali ke
labu (Depkes, 2000). Umumnya
dilakukan pengulangan proses pada residu pertama sampai 3-5 kali sehingga dapat
termasuk proses ekstraksi sempurna (Depkes,
2000).
2.
Sokletasi
Sokletasi
adalah ekstraksi kontinyu
menggunakan alat soklet.
Pelarut akan terdestilasi dari labu menuju pendingin, kemudian
jatuh membasahi dan merendam sampel yang mengisi bagiantengah alat soklet,
setelah pelarut mencapai tinggi tertentu maka akan turun ke labu destilasi,
demikian berulang ulang (Depkes, 2000).
3.
Digesti
Digesti adalah maserasi kinetik (dengan pengadukan
kontinyu) pada temperatur
ruangan, yaitu secara umum dilakukan pada temperatur 40-50oC
(Depkes, 2000).
4. Infus
Infus
adalah sediaan cair yang dibuat dengan menyari simplisia nabati dengan air pada
suhu 90oC selama 15 menit (Depkes, 2000).
5. Dekok
Dekok adalah infus pada waktu yang lebih lama (suhu
lebih dari 30oC) dan temperatur sampai titik didih air
(Depkes, 2000).
BAB III
METODOLOGI
3.1 Alat
1. Neraca analitik
2. Gelas piala 100 mL dan 250 mL
3. Erlenmeyer 100 mL
4. Buret 50 mL
5. Labu Ukur 100 mL dan 250 mL
6. Kaca Arloji
7. Pengaduk Kaca
8. Pipet Ukur 10 mL
9. Pipet tetes
10.
Indikator Universal
11.
Saringan
12.
Corong Gelas
13.
Kompor Listrik
14.
Tabung Reaksi dan Rak
15.
Statif dan Klem
16. Plat tetes
17. Spatula
18. Mortar
3.2 Bahan
1. Bahan Alam (Kunyit, Kayu Secang, Bunga Sepatu, Bunga Bugenvil, Kubis
Ungu)
2.
Sampel Tahu
3.
HCl
0,1 N
4. NaOH 0,1 N
5. Na2CO3.2H2O
0,14 N
6. Na2B4O7.10H2O
0,2 N
7. Indikator Fenolftalein
8. Akuades
3.3 Cara Kerja
3.3.1 Pembuatan
Indikator Alam (metode maserasi)
Kunyit 25 gram ditumbuk hingga halus
menggunakan mortar, kemudian dimasukkan dalam gelas piala 100 mL. Larutan kunyit
dilarutkan dengan 50 mL akuades panas sambil diaduk. Selanjutnya didiamkan
selama 1 hari, sehingga diperoleh larutan indikator alami kunyit. Langkah
diulangi untuk kayu secang, kol ungu, bunga bugenvil, bunga sepatu
3.3.2 Pembuatan Larutan
Natrium Hidroksida (NaOH) 0,1 N
NaOH 0,4 gram dilarutkan
dengan sedikit akuades dalam gelas piala 100 mL, kemudian NaOH diaduk hingga larut. Larutan
NaOH dimasukkan ke dalam labu ukur 100 mL dan diencerkan dengan akuades hingga
tanda batas. Selanjutnya larutan diseka
dan digojog homogen.
3.3.3 Pembuatan Larutan
HCl 0,1 N
Larutan HCl pekat dipipet sebanyak
2,076 mL ke dalam labu ukur 250 mL, kemudian diencerkan dengan akuades hingga
tanda batas. Larutan HCl 0,1 N diseka dan digojog hingga homogen.
3.3.4 Pembuatan Larutan
Na2B4O7.10H2O 0,2 N
Na2B4O7.10H2O
3,81 gram dilarutkan dengan sedikit akuades dalam gelas piala 100 mL dan diaduk
hingga larut. Larutan dipindah ke dalam labu ukur 100 mL, kemudian diencerkan
dengan akuades hingga tanda batas. Selanjutnya, larutan diseka dan digojog
homogen.
3.3.5 Pembuatan Larutan Na2CO3.2H2O
0,14 N sebanyak
100 mL
Na2CO3.2H2O
1,06 gram dilarutkan dengan
sedikit akuades dalam gelas piala 100 mL dan diaduk hingga larut. Larutan dipindah
ke dalam labu ukur 100 mL dan diencerkan dengan akuades hingga tanda batas.
Kemudian larutan diseka dan digojog homogen.
3.3.6 Penentuan Range pH Indikator Alam
Larutan pH 2 ditetesi pada plat
tetes (5 titik). Masing-masing titik
larutan pH 2 ditetesi dengan 5 indikator alam. Larutan pH 2 diamati perubahan
warna yang terjadi dan dicatat. Penetesan diulangi pada PH 4, 6, 8, 10 dan 12.
3.3.7
Uji
Indikator pada tahu
Pada sampel tahu berborak dan tahu
non borak, sampel tahu diletakkan pada plat tetes masing-masing 5 titik. Masing-masing
titik tahu borak dan non borak ditetesi menggunakan indikator alam. Kemudian
diamati perubahan warna yang terjadi pada masing-masing tahu. Penetesan sampel
tahu dilakukan berulang pada hari ke-2,
ke-3, ke-4, dan ke-5. Perubahan warna yang terjadi pada tahu tiap harinya
diamati dan dicatat
3.3.8 Standarisasi
Larutan HCl 0,1 N
Natrium karbonat dihidrat 0,53 gram dimasukkan
dalam gelas piala 100 mL. Larutan dilarutkan dengan sedikit akuades dan diaduk
hingga larut. Selanjutnya larutan dipindah larutan ke dalam labu ukur 100 mL
dan diencerkan hingga tanda batas. Kemudian larutan diseka dan digojog homogen
Larutan Na2CO3.2H2O
0,14 N dipipet sebanyak 10 mL ke dalam
erlenmeyer 100 mL. Larutan ditambah 3 tetes indikator PP. Campuran dititrasi menggunakan
larutan HCl 0,1 N hingga menjadi tidak berwarna. Volume HCl yang dibutuhkan
untuk titrasi dicatat. Langkah diulangi sebanyak 3 kali
3.3.9
Penentuan Konsentrasi Larutan Boraks dengan Indikator PP dan Indikator Alam
Larutan
dinatrium tetraborat anhidrat (borak) dipipet sebanyak 10 mL ke dalam erlenmeyer
100 mL. Kemudian ditambah 3
tetes
indikator PP. Larutan dititrasi dengan HCl 0,1 N sampai terjadi perubahan
warna. Selanjutnya volume HCl 0,1 N yang diperlukan untuk menitrasi dicatat. Langkah
diulangi sebanyak 3 kali titrasi dan diulangi dengan mengganti indikator PP
dengan indikator alam.
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
4.1
Preparasi
Indikator Alami
Indikator
alami merupakan bahan-bahan alam yang dapat berubah warnanya dalam larutan
asam,basa, dan netral, namun tidak bisa menunjukkan nilai pH-nya. Pengambilan warna indikator alami dilakukan dengan proses
ekstraksi. Proses ini melibatkan adanya transfer massa dari padatan ke fasa
cairan yang lebih dikenal dengan ektraksi padat cair. Peristiwa ekstraksi dapat
dianggap sebagai transfer massa yang meliputi difusi zat warna dari dalam
padatan ke permukaan padatan, perpindahan massa zat warna dari permukaan
padatan ke cairan dan difusi zat warna di dalam cairan (Samun, 2008). Penggunaan
indikator alami ini
diawali dengan proses ekstraksi dari bahan
alam misalnya pada bunga, kubis, ataupun umbi-umbian. Bahan pengekstrak
dalam hal ektraksi padat cair disebut sebagai fasa cair antara lain akuades,
akuades panas, n-heksana, metanol, campuran metanol - HCl dan campuran etanol
- air (Bayu , 2008).
Ekstraksi dilakukan menggunakan fasa cair akuades panas dengan metode maserasi. Maserasi
merupakan proses pengekstrakan simplisia dengan menggunakan pelarut dengan
beberapa kali pengocokan atau pengadukan pada suhu kamar (Syamsuni, 2006). Bahan alami yang
digunakan yaitu kunyit, bunga sepatu, bunga bugenvil, kubis Uungu dan kayu secang.
Preparasi dilakukan dengan menumbuh bahan-bahan alami menggunakan mortar.
Masing-masing bahan alami dimaserasi dengan pelarut akuades panas dalam wadah
dan di tunggu selama 24 jam. Hasil ekstrak indikator alami ini diletakkan dalam
wadah yang tertutup untuk menghindari kemungkinan adanya pengaruh lingkungan
yang bisa berdampak pada perubahan sifat kimia dari indikator. Masing-masing
indikator ini akan menghasilkan warna ekstrak yang berbeda-beda. Prinsip
indikator alami ini adalah bahan yang memberikan warna berbeda pada setiap
lingkungan asam basa. Seperti telah diketahui bahwa
indikator alami mempunyai kelemahan yaitu indikator alami dalam bentuk larutan
mudah rusak, larutan tidak tahan lama dan berbau tidak sedap. Hal ini juga akan
mempengaruhi tingkat kecermatan dan keakuratannya jika digunakan sebagai
indikator titrasi asam basa (Marwati, 2010). Agar indikator tersebut dapat
digunakan dalam waktu yang relatif lama (kurang lebih 3 bulan) maka indikator
tersebut disimpan pada temperatur 15 oC (Marwati, 2011). Oleh karena
itu preparasi indikator alami titrasi asam basa perlu meninjau tingkat
kestabilan dari senyawa-senyawa zat warna yang terdapat dalam tumbuhan.
4.2
Penentuan
Rentang pH pada Indikator Alam
Sebelum
melakukan pengujian indikator, terlebih dahulu mengukur rentang pH pada tiap
indikator alam. Tujuannya, untuk mengetahui rentang PH dari tiap indikator yang
diuji. Pada pengukuran pH, yang
dilakukan yaitu membuat larutan buffer pada pH 2, 4, 6, 8, 10, dan 12. Melalui
larutan pH ini, dapat diketahui perubahan warna pada indikator alam. Karakter berupa trayek pH juga
dipengaruhi oleh fasa cair yang digunakan pada proses ektraksi. Hal ini dapat
dilihat contoh perubahan warna untuk setiap perubahan pH pada Tabel 4.1
Berdasarkan
Tabel 4.1 dapat diketahui rentang pH tiap indikator alam. Pada indikator kayu secang
rentang pH 4- 6 terjadi perubahan warna dari kuning hingga orange
kecoklatan, pada pH 6 - 8 perubahan warna yang terjadi dari orange kecoklatan
sampai berwarna merah muda. Kedua, pada indikator bunga sepatu rentang pH terjadi pada
pH 6 - 8 yaitu perubahan warna merah kecoklatan hingga coklat bening, kemudian
pada pH 10 - 12 terjadi perubahan dari berwarna coklat kehijauan hingga
berwarna hijau tua. Ketiga, pada indikator bunga bugenvil rentang pHnya ≤6 - 8 dengan perubahan
warna dari merah muda hingga coklat keunguan. Keempat, pada kubis ungu terjadi perubahan warna pada rentang
pH 2 - 4 dari warna merah muda sampai ungu muda. Selanjutnya pada pH 8 - 10
terjadi perubahan warna dari ungu kebiruan hingga biru pucat. Kemudian
perubahan warna dari biru pucat menjadi hijau terjadi pada rentang pH 10 - 12.
Kelima, pada
indikator kunyit hanya terjadi rentang pH pada pH 6 - 8 yaitu perubahan warna
dari kuning kecoklatan menjadi coklat kekuningan.
4.1
Uji
Indikator Alam pada Tahu Tidak berborak dan Tahu Berborak
Pada
uji borak, dilakukan penetesan pada 2 sampel tahu yaitu tahu tidak berborak dan
tahu yang diberi borak menggunakan indikator alam selama 5 hari. Kedua sampel
tahu tersebut diletakkan pada plat tetes yang berbeda. Plat tetes yang
digunakan pada praktikum ini merupakan plat atau tempat (wadah) yang memang digunakan
untuk penetesan. Masing-masing sampel tersebut diambil sedikit dan diletakkan
pada plat tetes, masing-masing sebanyak 5 titik. Kemudian sampel ditetesi
indikator alam pada titik-titik tersebut. Perlakuan ini dilakukan selama 5 hari berturut-turut.
Hal ini dimaksudkan untuk mengetahui apakah ada perubahan asam basa pada 2
sampel tahu tersebut terkait dengan perubahan warna selama uji 5 hari. Saat penetesan,
dicatat setiap perubahan warnanya. Hasil perubahan warna pada sampel tahu
selama 5 hari dapat dilihat pada Tabel 4.2.
Berdasarkan
Tabel 4.2, diperoleh indikator alami yang menunjukkan reaksinya pada uji tahu
berborak, yaitu pada indikator kayu secang dan kubis ungu. Pada penetesan hari
pertama, indikator kayu secang dan kubis ungu sudah menunjukkan perbedaan warna
pada sampel tahu non borak dan tahu berborak. Namun, indikator kayu secang
hanya mampu bertahan pada uji tahu berborak sampai hari ke-2. Untuk indikator
kubis ungu mampu memberikan reaksinya pada usia tahu 3 hari (hari ke-3).
Kandungan kimia dari kayu secang meliputi asam galat, tanin, resin, resorsin, brasilin,
brasilein, d-alfa-phellandrene, oscimene, minyak atsiri.
Warna merah yang dihasilkan oleh kayu secang merupakan komposit brazilin yang terdiri dari
senyawa brazilin, brazilein, dan 3’-O-metilbrazilin. Brazilin (C16H14O5) adalah zat
warna merah dari kayu secang yang terbentuk pada ekstrak cair pada suasana pH
netral. Sedangkan perubahan
warna pada kubis ungu ini sesuai dengan
perubahan warna pada antosianin untuk setiap perubahan pH (Harborn, 1987) dan (Aji, 2010). Perubahan
warna untuk setiap perubahan pH berbeda-beda tergantung dari proses
ekstraksinya dan kesetabilan senyawa antosianin. Secara kimiawi antosianin
merupakan struktur aromatik
tunggal, yaitu sianidin dan semuanya terbentuk dari pigmen sianidin ini
dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi
(Harborn, 1987).
4.1
Standarisasi
Larutan HCl 0,1 N menggunakan larutan Na2CO3.2H2O 0,14 N
Standarisasi
adalah proses yang digunakan untuk menentukan secara teliti konsentrasi suatu
larutan. Terdapat dua macam larutan standar yaitu standar primer dan standar
sekunder. Standar primer biasanya dibuat dengan cara menimbang dengan teliti
suatu solute kemudian melarutkannya ke dalam volume larutan yang secara teliti
diukur volumenya. Syarat-syarat dari standar primer adalah :
1. Murni, jumlah
pengotornya tidak lebih dari 0.01 - 0.02%
2. Stabil, tidak higroskopis dan tidak mudah bereaksi
dengan udara
3. Mempunyai berat ekivalen yang cukup tinggi untuk
mengurangi kesalahan
pada waktu penimbangan.
Larutan
standar primer digunakan untuk menstandarisasi larutan standar sekunder,
larutan standar sekunder selanjutnya digunakan untuk penentuan suatu larutan
atau cuplikan.
Larutan
baku sekunder pada percobaan ini adalah asam klorida (HCl) karena berat
molekulnya lebih kecil dan derajat kemurnian lebih rendah daripada larutan baku
primer, larutannya relatif stabil dalam penyimpanan, Sedangkan yang bertindak
sebagai larutan baku primer adalah natrium karbonat (Na2CO3.2H2O),
karena berat molekulnya lebih besar, mudah diperoleh, dimurnikan, dikeringkan
dan disimpan dalam keadaan murni, tidak bersifat higroskopis dan tidak berubah
berat dalam penimbangan di udara. Natrium karbonat
adalah zat padat, halus, putih, larut baik dalam air.
Pada
standarisasi larutan HCl dengan natrium karbonat dihidrat (Na2CO3.2H2O),
diperoleh reaksi antara HCl dengan Na2CO3.2H2O seperti
di bawah
ini :
Hal
yang pertama yang dilakukan dengan menimbang 1,06 gram natrium karbonat dihidrat
(Na2CO3.2H2O) dan melarutkannya ke dalam labu
ukur 100 mL dengan penambahan akuades sampai tanda batas, kemudian diseka dan
dihomogenkan. Dalam larutan Na2CO3.2H2O 0,14
N yang telah dibuat, selanjutnya diambil 10 mL larutan Na2CO3.2H2O dan
dimasukkan dalam erlenmeyer 100 mL, kemudian ditambahkan 3 tetes indikator PP. Penambahan
indikator PP berfungsi untuk menentukan titik akhir titrasi asam basa, dimana
warna akan berubah setelah larutan menjadi netral. Perubahan warna ini
dipengaruhi oleh pH lingkungan. Larutan Na2CO3.2H2O
ini dititrasi dengan asam klorida (HCl), sampai terjadi perubahan warna
dari berwarna merah muda menjadi tak berwarna. Titrasi ini dilakukan sebanyak 3 kali (triplo). Berdasarkan
hasil titrasi, volume yang dibutuhkkan HCl untuk mencapai titik ekuivalen dan konsentrasi larutan HCl yang
terhitung dapat dilihat pada Tabel 4.3.
Pada
Tabel 4.3 nilai konsentrasi larutan HCl dihitung menggunakan rumus:
mgrek asam =
mgrek basa
Hasil
konsentrasi yang terhitung ini terdapat perbedaan dari hasil konsentrasi yang
diperoleh dengan pengenceran. Hal ini kemungkinan disebabkan oleh kurangnya
ketelitian dalam pengenceran larutan. Standarisasi HCl dengan Na2CO3.2H2O ini
menggunakan prinsip titrasi asidimetri. Alasan penggunaan titrasi asidimetri
adalah karena sampel yang dianalisis bersifat basa, oleh sebab itu, titrantnya
harus suatu larutan baku sekunder yang bersifat asam (titrasi asidimetri).
4.1 Penentuan Konsentrasi Larutan Borak
Menggunakan Indikator Alami dan Indikator Konvensional (indikator PP)
Penentuan
konsentrasi larutan borak bertujuan
untuk menentukan nilai konsentrasi larutan borak setelah ditambahkan indikator
konvensional (PP) dan indikator alami. Langkah awal yang dilakukan yaitu
melakukan titrasi larutan boraks menggunakan larutan HCl 0,1 N. Titrasi ini
dilakukan menggunakan 3 indikator yaitu indikator PP, indikator kayu secang dan
indikator kubis ungu. Pada awal titrasi dilakukan menggunakan indikator PP
sebagai pengujian konvensionalnya. Larutan borak diambil sebanyak 10 mL dan
dimasukkan ke dalam erlenmeyer 100 mL. Kemudian ditambahkan 3 tetes indikator
PP. Titik akhir titrasi ditandai dengan perubahan warna dari merah muda menjadi
tidak berwarna. Titrasi dilakukan berulang sebanyak 3 kali (triplo). Jumlah
volume HCl yang dibutuhkan untuk mencapai titik akhir titrasi yaitu sebesar 19,7
mL; 20,0 mL dan 20,6 mL.
Selanjutnya,
dilakukan titrasi juga menggunakan indikator alam yaitu indikator kayu secang
dan indikator kubis ungu. Langkah yang dilakukan sam dengan titrasi menggunakan
indikator PP, hanya saja indikatornya diganti menggunakan indikator kayu secang
dan kubis ungu. Titrasi juga dilakukan pengulangan masing-masing sebanyak 3
kali. Pada titrasi menggunakan indikator kayu secang, terjadi perubahan warna
dari berwarna pink keorange menjadi orange. Perubahan warna indikator kayu
secang terjadi pada rentang pH 2 - 4. Volume yang dibutuhkan HCl untuk mencapai
titik akhir titasi larutan borak menggunakan indikator kayu secang sebesar 19,4
mL; 19,9 mL dan 20,1 mL, sehingga diperoleh nilai rata-rata volume titrasi
indikator kayu secang sebesar 19,8 mL. Sedangkan untuk titrasi menggunakan
indikator kubis ungu, titik akhir titrasinya ditandai dengan perubahan warna
dari ungu bening menjadi ungu kehijauan. Sehingga rentang pH yang terjadi
antara pH 6 - 8. Sehingga, volume yang dibutuhkan untuk mencapai titik akhir titasi pada
larutan boraks menggunakan indikator kubis ungu sebesar 20,4 mL; 20,5 mL dan
20,5 mL dengan nilai rata-rata volume titrasi indikator kubis ungu sebesar 20,5
mL.
Hasil
titrasi menggunakan indikator konvensional dan indikator alam yang diperoleh selanjutnya
ditentukan konsentrasi larutan borak
menggunakan indikator konvensional (PP) dan indikator alami. Hasil konsentrasi
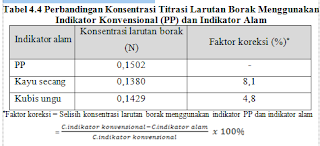
titrasi larutan boraks dapat dilihat pada Tabel 4.4.
Pada Tabel
4.4 menunjukkan hasil perbandingan nilai
konsentrasi menggunakan indikator kubis ungu merupakan indikator yang paling
baik, yaitu mendekati nilai konsentrasi larutan borak menggunakan indikator
konvensional. Hal ini menunjukkan bahwa selisih konsentrasi larutan borak menggunakan
indikator konvensional (PP) dan menggunakan indikator kubis ungu untuk
pengujian borak lebih kecil daripada penggunaan indikator kayu secang.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Kesimpulan
yang diperoleh dari hasil analisis yaitu:
1.
Pada proses uji indikator pada tahu non borak dan tahu berborak didapat
indikator kayu secang dan indikator kubis ungu yang lebih menunnjukkan
perubahan warna yang spesifik. Ini berarti, indikator kubis ungu dan kayu
secang dapat digunakan sebagai indikator alami untuk uji kualitatif borak.
2.
Pada hasil penentuan konsentrasi diperoleh nilai konsentrasi untuk
indikator konvensional (PP) sebesar 0,1502 N. Sedangkan untuk indikator kayu
secang dan kubis ungu berturut-turut sebesar 0,1380 N dan 0,1429 N. Perbandingan
selisih konsentrasi (%) larutan borak antara penggunaan indikator konvensional
(PP) - kayu secang dan indikator konvensional (PP) - kubis ungu terdapat
perbedaan selisihnya yaitu berturut-turut 8,1 % dan 4,8 %. Hal ini menunjukkan
bahwasannya selisih penggunaan indikator PP dengan indikator kubis ungu lebih kecil
jika dibandingkan indikator kayu secang.
5.2 Saran
Saran yang diberikan untuk pengujian indikator alam
sebagai uji borak selanjutnya yaitu:
1. Pembuatan larutan asam dan basa menggunakan larutan
buffer untuk mendapatkan hasil yang lebih akurat.
2. Dilakukan penelitian lanjutan menggunakan larutan
selain borak untuk mengetahui faktor koreksi indikator alam pada titrasi selain
titrasi borak.
DAFTAR
PUSTAKA
Aji C. M. 2010. Karaktrisasi trayek pH dan Spektrum Absorpsi Kubis Ungu (Brassica
oleracea L). Laporan Penelitan FMIPA UNY: Yogyakarta
Bayu, K. 2008. Penggunaan ekstrak zat warna bunga pukul
empat (Mirabilis jalapa L) sebagai indikator alami dalam titrasi asam basa. Skripsi. FMIPA UNAIR: Jember
Cahyadi,
W. 2008. Analisis dan Aspek Kesehatan Bahan Tambahan Pangan. Edisi kedua.
Cetakan 1. Bumi Aksara: Jakarta
Day, R.
A Jr., dan Underwood, A.L. 2002. Analisis
Kimia Kuantitatif. Erlangga: Jakarta
Depkes.
2000. Parameter Standar Umim Ekstrak
Tumbuhan Obat. Direktorat Jendral POM – Departemen Kesehatan RI:
Jakarta
Fessenden, R. J.,
Fessenden, J. S. 1995. Kimia Organik
Edisi ketiga Jilid I (Terjemahan Hendyana Pujaatmaka). Erlangga: Jakarta
Harborne J.B. 1987. Phytochemistry Methods. New York : Wiley
Izonfuo, L. T.,
Fekamhorhobo, G. K., Obomanu,
G. K., Daworiye, L. T.. 2006. Acid Base Indicator Properties of
Dye from Local Plant: Bassella alba and Hibiscus rosasinencis, Journal
of Applied Sciences and Environmental Managemen. Vol 10, No 1, hal.5-8
Khamid.
1993. Bahaya Boraks Bagi Kesehatan. Penerbit
Kompas: Jakarta
Marwati,
S. 2010. Aplikasi Beberapa Bunga Berwarna sebagai Indikator Alami Titrasi Asam
Basa. Prosiding Seminar Nasional
Penelitian, Pendidikan dan Penerapan MIPA FMIPA UNY.
Marwati, S.
2011. Kestabilan warna Ekstrak Kubis Ungu (Brassica
oleracea) sebagai Indikator Alami Titrasi Asam Basa. Prosiding Seminar Nasional
Penelitian, Pendidikan dan Penerapan MIPA FMIPA UNY.
Pruetong, S., Saijeen, S.,
Thongfak, K. 2009. Study and Processing of Plant Extracts for Use as pH
Indicators. International Conference on the Role of Universities in Hands-On
Education Rajamangala University of Technology Lanna. 23-29 August 2009. Chiang-Mai. Thailand
Shisir, M. N., Laxman,
J. R., Vinayak, R. N., Jacky, D. R., Bhimrao, G. S. 2006 Use of Miriabilis Jalapa L Flower
Extracts as a Natural Indicator in Acid Base Titration. Journal of Pharmacy Research, Vol 1, hal. 2
Triastuti,
Endang., Fatimawali., Max Revolta J.R,. 2013. Analisis Boraks pada Tahu yang
diproduksi di Kota Manado. Jurnal Ilmiah
Farmasi-UNSRAT Vol. 2, No. 01, hal. 2302 - 2493.
Tutik, R. dan Das, S. 2007. Pengembangan Prosedur
Penentuan Kadar Asam Cuka secara Titrasi Asam Basa dengan Berbagai
Indikator Alami (Sebagai Alternatif Praktikum Titrasi Asam Basa di SMA. Laporan Penelitian. FMIPA UNY: Yogyakarta.
Tutik,
R. P., Siti M., Antuni W. 2012. Karakter Ekstrak
Zat Warna Kayu Secang
(Caesalpinia Sappan L) Sebagai Indikator Titrasi Asam Basa. Prosiding
Seminar Nasional Penelitian, Pendidikan Dan Penerapan Mipa Fmipa UNY.
Vogel.
1985. Buku Teks
Analisis Anorganik Kualitatif
Makro dan Semimikro (Terjemahan).
PT Kalman Media Pustaka: Jakarta
Widyaningsih,
T. D. dan Murtini, E.S. 2006. Alternatif
Pengganti Formalin Pada Produk Pangan. Trubus Agrisarana: Jakarta.
Yuliarti
dan Nurheti. 2009. Awas! Dibalik Lezatnya
Makanan. Edisi I. Penerbit Andi: Yogyakarta.




Tidak ada komentar:
Posting Komentar