Sistem Koloid
Istilah koloid pertama kali diutarakan oleh seorang ilmuwan Inggris,
Thomas Graham, sewaktu mempelajari sifat difusi beberapa larutan melalui
membran kertas perkamen. Graham menemukan bahwa larutan natrium klorida
mudah berdifusi sedangkan kanji, gelatin, dan putih telur sangat lambat
atau sama sekali tidak berdifusi. Zat-zat yang sukar berdifusi tersebut
disebut koloid.
Tahun 1907, Ostwald, mengemukakan istilah sistem terdispersi bagi zat yang terdispersi dalam medium pendispersi. Analogi dalam larutan, fase terdispersi adalah zat terlarut, sedangkan medium pendispersi adalah zat pelarut. Sistem koloid termasuk salah satu sistem dispersi. Sistem dispersi lainnya adalah larutan dan suspensi. Larutan merupakan sistem dispersi yang ukuran partikelnya sangat kecil, sehingga tidak dapat dibedakan antara partikel dispersi dan pendispersi. Sedangkan suspensi merupakan sistem dispersi dengan partikel berukuran besar dan tersebar merata dalam medium pendispersinya
Sistem koloid adalah suatu bentuk campuran yang keadaannya terletak
antara larutan dan suspensi (campuran kasar). Secara makroskopis koloid tampak homogen, tetapi secara mikroskopis
bersifat heterogen. Campuran koloid umumnya bersifat stabil dan tidak
dapat disaring. Ukuran partikel koloid terletak antara 1 nm-10 nm. Sistem koloid sangat
berkaitan erat dengan hidup dan kehidupan kita sehari-hari. Cairan
tubuh, seperti darah adalah sistem koloid, bahan makanan seperti susu,
keju, nasi, dan roti adalah sistem koloid. Cat, berbagai jenis obat,
bahan kosmetik, tanah pertanian juga merupakan sistem koloid. Koloid
adalah suatu sistem campuran “metastabil” (seolah-olah stabil, tapi akan
memisah setelah waktu tertentu). Koloid berbeda dengan larutan; larutan
bersifat stabil.
PERBEDAAN LARUTAN SEJATI, SISTEM KOLOID, DAN SUSPENSI KASAR
Larutan
(Dispersi Molekuler)
|
Koloid
(Dispersi Koloid)
|
Suspensi
(Dispersi Kasar)
|
| Contoh: larutan gula dalam air | Contoh: campuran susu dengan air. | Contoh: campuran tepung terigu dengan air. |
|
|
|
Jenis – Jenis Koloid
|
Fase Terdispersi
|
Pendispersi
|
Nama koloid
|
Contoh
|
| Gas | Gas | Bukan koloid, karena gas bercampur secara homogen | |
| Gas | Cair | Busa | Buih, sabun, ombak, krim kocok |
| Gas | Padat | Busa padat | Batu apung, kasur busa |
| Cair | Gas | Aerosol cair | Obat semprot, kabut, hair spray di udara |
| Cair | Cair | Emulsi | Air santan, air susu, mayones |
| Cair | Padat | Gel | Mentega, agar-agar |
| Padat | Gas | Aerosol padat | Debu, gas knalpot, asap |
| Padat | Cair | Sol | Cat, tinta |
| Padat | Padat | Sol Padat | Tanah, kaca, lumpur |
1. Aerosol
2. Sol
 Sistem koloid dari partikel padat yang terdispersi dalam zat cair
disebut sol. Koloid jenis sol banyak kita temukan dalam kehidupan
sehari-hari maupun dalam industri.
Sistem koloid dari partikel padat yang terdispersi dalam zat cair
disebut sol. Koloid jenis sol banyak kita temukan dalam kehidupan
sehari-hari maupun dalam industri.
Sistem koloid dari cair yang terdispersi dalam zat cair lain disebut emulsi. Syarat terjadinya emulsi adalah kedua jenis zat cair itu tidak saling melarutkan. Emulsi terbeentuk karena adanya pengemulsi (emulgator). Contohnya adalah kasein dalam susu dan kuning telur dalam mayonise.
3. Buih
Sistem koloid dari gas yang terdispersi dalam zat cair disebut buih. Seperti halnya emulsi, untuk menstabilkan buih diperlukan zat pembuih, misalnya sabun, detergen, dan protein.
4. Gel
 Koloid yang setengah kaku (antara padat dan cair) disebut gel.
Contoh: agar-agar, lem kanji, selai, gelatin, gel sabun, dan gel silika.
Gel dapat dibentuk dari suatu sol yang zat terdispersinysa mengadsorbsi
medium dispersinya sehingga terjadi koloid yang agak padat.
Koloid yang setengah kaku (antara padat dan cair) disebut gel.
Contoh: agar-agar, lem kanji, selai, gelatin, gel sabun, dan gel silika.
Gel dapat dibentuk dari suatu sol yang zat terdispersinysa mengadsorbsi
medium dispersinya sehingga terjadi koloid yang agak padat.
Berdasarkan sifat keelastisitasnya, gel dapat dibagi menjadi:
1.Gel elastis
Gel yang bersifat elastis, yaitu dapat berubah bentuk jika diberi gaya dan kembali ke bentuk awal jika gaya ditiadakan. Contoh adalah sabun dan gelatin.
2. Gel non-elastis
Gel yang bersifat tidak elastis, artinya tidak berubah jika diberi gaya. Contoh adalah gel silika.
5. Emulsi
B. Sifat Koloid


Sistem koloid dari partikel padat atau cair yang terdispesi dalm gas
disebut aerosol. Jika zat yang terdispersi berupa zat padat, disebut
aerosol padat; jika zat yang tyerdispersi berupa zat cair, disebut
aerosol cair. Dewasa ini banyak produk dibuat dalam bentuk aerosol,
seperti semprot rambut (hair spray), semprot obat nyamuk, parfum, cat semprot, dan lain-lain.

Sistem koloid dari cair yang terdispersi dalam zat cair lain disebut emulsi. Syarat terjadinya emulsi adalah kedua jenis zat cair itu tidak saling melarutkan. Emulsi terbeentuk karena adanya pengemulsi (emulgator). Contohnya adalah kasein dalam susu dan kuning telur dalam mayonise.
3. Buih
Sistem koloid dari gas yang terdispersi dalam zat cair disebut buih. Seperti halnya emulsi, untuk menstabilkan buih diperlukan zat pembuih, misalnya sabun, detergen, dan protein.
4. Gel

Berdasarkan sifat keelastisitasnya, gel dapat dibagi menjadi:
1.Gel elastis
Gel yang bersifat elastis, yaitu dapat berubah bentuk jika diberi gaya dan kembali ke bentuk awal jika gaya ditiadakan. Contoh adalah sabun dan gelatin.
2. Gel non-elastis
Gel yang bersifat tidak elastis, artinya tidak berubah jika diberi gaya. Contoh adalah gel silika.
5. Emulsi
Sistem koloid dari zat cair yang terdispersi dalam zat cair disebut emulsi. Syarat terjadinya emulsi ini adalah kedua zat
cair tidak saling melarutkan. Emulsi dapat digolongkan menjadi dua
bagian, yaitu emulsi minyak dalam air atau emulsi air dalam minyak.
Contoh emulsi minyak dalam air adalah santan, susu, dan lateks. Contoh
emulsi air dalam minyak adalah minyak ikan, minyak bumi.
Emulsi terbentuk karena adanya zat
pengemulsi (emulgator), contoh emulgator adalah sabun yang dapat
mengemulsikan minyak dalam air. Contoh emulgator lainnya adalah kasein
dalam susu dan kuning telur dalam mayonaise.
B. Sifat Koloid
- Efek Tyndall
Efek Tyndall adalah penghamburan cahaya oleh larutan koloid,
peristiwa di mana jalannya sinar dalam koloid dapat terlihat karena
partikel koloid dapat menghamburkan sinar ke segala jurusan. Contoh:
sinar matahari yang dihamburkan partikel koloid di angkasa, hingga
langit berwarna biru pada siang hari dan jingga pada sore hari ; debu
dalam ruangan akan terlihat jika ada sinar masuk
melalui celah. Efek Tyndall juga dapat menjelaskan mengapa langit pada siang hari
berwarna biru sedangkan pada saat matahari terbenam, langit di ufuk
barat berwarna jingga atau merah. Hal itu disebabkan oleh penghamburan
cahaya matahari oleh partikel koloid di angkasa dan tidak semua
frekuensi dari sinar matahari dihamburkan dengan intensitas sama. Jika intensitas cahaya yang dihamburkan
berbanding lurus dengan frekuensi, maka pada waktu siang hari ketika
matahari melintas di atas kita frekuensi paling tinggi (warna biru) yang
banyak dihamburkan, sehingga kita melihat langit berwarna biru.
Sedangkan ketika matahari terbenam, hamburan frekuensi rendah (warna
merah) lebih banyak dihamburkan, sehingga kita melihat langit berwarna
jingga atau merah.
Gejala efek tyndall yang dapat diamati dalam kehidupan sehari-hari adalah sebagai berikut:
– Sorot lampu mobil pada malam yang berkabut
– Sorot lampu proyektor dalam gedung bioskop yang berasap dan berdebu
– Berkas sinar matahari melalui celah pohon-pohon pada pagi yang berkabut

- Gerak Brown
Gerak brown merupakan gerak patah-patah (zig-zag) partikel koloid yang terus menerus dan hanya dapat diamati dengan mikroskop ultra. Gerak brown terjadi sebagai akibat tumbukan yang tidak seimbang dari molekul-molekul medium terhadap partikel koloid. Dalam
suspensi tidak terjadi gerak Brown karena ukuran partikel cukup besar,
sehingga tumbukan yang dialaminya setimbang. Partikel zat terlarut juga
mengalami gerak Brown, tetapi tidak dapat diamati. Semakin tinggi suhu,
maka gerak brown yang terjadi juga semakin cepat, karena energi molekul
medium meningkat sehingga menghasilkan tumbukan yang lebih kuat.
Gerak Brown merupakan faktor penyebab
stabilnya partikel koloid dalam medium dispersinya. Gerak brown yang
terus menerus dapat mengimbangi gaya gravitasi sehingga partikel koloid
tidak mengalami sedimentasi (pengendapan).

- Adsorbsi Koloid
Adsorpsi adalah peristiwa di mana suatu zat menempel pada permukaan zat lain, seperti ion H+ dan OH– dari
medium pendispersi. Untuk berlangsungnya adsorpsi, minimum harus ada
dua macam zat, yaitu zat yang tertarik disebut adsorbat, dan zat yang
menarik disebut adsorban. Apabila terjadi penyerapan ion ada permukaan
partikel koloid maka partikel koloid dapat bermuatan listrik yang
muatannya ditentukan oleh muatan ion-ion yang mengelilinginya.
Partikel
koloid mempunyai kemampuan menyerap ion atau muatan listrik pada
permukaannya. Oleh karena itu partikel koloid bermuatan listrik.
Penyerapan pada permukaan ini disebut dengan adsorpsi. Contohnya sol
Fe(OH)3 dalam air mengadsorpsi ion positif sehingga bermuatan positif dan sol As2S3
mengadsorpsi ion negatif sehingga bermuatan negatif. Pemanfaatan sifat
adsorpsi koloid dalam kehidupan antara lain dalam proses pemutihan gula
tebu, dalam pembuatan norit (tablet yang terbuat dari karbon aktif) dan
dalam proses penjernihan air dengan penambahan tawas.

- Muatan Koloid dan Elektroforesis
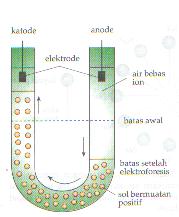
Partikel koloid mempunyai kemampuan menyerap ion atau muatan listrik
pada permukaannya. Oleh karena itu partikel koloid manjadi bermuatan
listrik. Penyerapan pada permukaan ini di sebut adsorpsi. Karena partikel koloid mempunyai muatan maka dapat bergerak dalam
medan listrik. Jika ke dalam koloid dimasukkan arus searah melalui
elektroda, maka koloid bermuatan positif akan bergerak menuju elektroda
negatif dan sesampai di elektroda negatif akan terjadi penetralan muatan
dan koloid akan menggumpal (koagulasi).
- Koagulasi Koloid
Koagulasi koloid adalah penggumpalan koloid karena elektrolit yang
muatannya berlawanan. Contoh: kotoran pada air yang digumpalkan oleh
tawas sehingga air menjadi jernih.
Faktor-faktor yang menyebabkan koagulasi:
- Perubahan suhu.
- Pengadukan.
- Penambahan ion dengan muatan besar (contoh: tawas).
- Pencampuran koloid positif dan koloid negatif.
- Koloid Pelindung

Sistem koloid di mana partikel terdispersinya mempunyai daya adsorpsi
relatif besar disebut koloid liofil yang bersifat lebih stabil.
Sedangkan jika partikel terdispersinya mempunyai gaya absorpsi yang
cukup kecil, maka disebut koloid liofob yang bersifat kurang stabil.
Yang berfungsi sebagai koloid pelindung ialah koloid liofil.
Sol liofob/ hidrofob mudah terkoagulasi dengan sedikit penambahan
elektrolit, tetapi menjadi lebih stabil jika ditambahkan koloid
pelindung yaitu koloid liofil. Berikut ini penjelasan yang lebih lengkap
mengenai koloid liofil dan liofob:
- Koloid liofil (suka cairan) adalah koloid di mana terdapat gaya tarik menarik yang cukup besar antara fase terdispersi dan medium pendispersi. Contoh, disperse kanji, sabun, deterjen.
- Koloid liofob (tidak suka cairan) adalah koloid di mana terdapat gaya tarik-menarik yang lemah atau bahkan tidak ada sama sekali antar fase terdispersi dan medium pendispersinya. Contoh, disperse emas, belerang dalam air.
- Dialisis
Pada pembuatan koloid, sering kali terdapat ion-ion yang dapat
mengganggu kesetabilan koloid tersebut. Ion-ion pengganggu ini dapat
dihilangkan dengan suatu proses yang disebut dialisis.
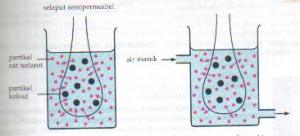
Dalam proses ini, sistem koloid dimasukkan kedalam kantong koloid,
lalu kantong koloid itu di masukkan kedalam bejana yang berisi air
mengalir (lihat gambar). Kantong koloid terbuat dari selaput semipemeable,
yaitu selaput yang dapat melewatkan partikel-partikel kecil, seperti
ion-ion atau molekul sederhana, tetapi menahan koloid. Dengan demikian,
ion-ion keluar dari kantong dan hanyut bersama air.
PERBANDINGAN SIFAT SOL LIOFIL DAN SOL LIOFOB
Koloid Liofob adalah kolid yang tidak mengadsorbsi cairan. Agar muatan koloid stabil, cairan pendispersi harus bebas dari elektrolit dengan cara dialisis, yakni pemurnian medium pendispersi dari elektrolit.
|
Sifat-Sifat
|
Sol Liofil
|
Sol Liofob
|
| Pembuatan | Dapat dibuat langsung dengan mencampurkan fase terdispersi dengan medium terdispersinya | Tidak dapat dibuat hanya dengan mencampur fase terdispersi dan medium pendisperinya |
| Muatan partikel | Mempunyai muatan yang kecil atau tidak bermuatan | Memiliki muatan positif atau negative |
| Adsorpsi medium pendispersi | Partikel-partikel sol liofil mengadsorpsi medium pendispersinya. Terdapat proses solvasi/ hidrasi, yaitu terbentuknya lapisan medium pendispersi yang teradsorpsi di sekeliling partikel sehingga menyebabkan partikel sol liofil tidak saling bergabung | Partikel-partikel sol liofob tidak mengadsorpsi medium pendispersinya. Muatan partikel diperoleh dari adsorpsi partikel-partikel ion yang bermuatan listrik |
| Viskositas (kekentalan) | Viskositas sol liofil > viskositas medium pendispersi | Viskositas sol hidrofob hampir sama dengan viskositas medium pendispersi |
| Penggumpalan | Tidak mudah menggumpal dengan penambahan elektrolit | Mudah menggumpal dengan penambahan elektrolit karena mempunyai muatan. |
| Sifat reversibel | Reversibel, artinya fase terdispersi sol liofil dapat dipisahkan dengan koagulasi, kemudian dapat diubah kembali menjadi sol dengan penambahan medium pendispersinya. | Irreversibel artinya sol liofob yang telah menggumpal tidak dapat diubah menjadi sol |
| Efek Tyndall | Memberikan efek Tyndall yang lemah | Memberikan efek Tyndall yang jelas |
| Migrasi dalam medan listrik | Dapat bermigrasi ke anode, katode, atau tidak bermigrasi sama sekali | Akan bergerak ke anode atau katode, tergantung jenis muatan partikel |
- Koloid Liofil dan Koloid Liofob
Koloid Liofob adalah kolid yang tidak mengadsorbsi cairan. Agar muatan koloid stabil, cairan pendispersi harus bebas dari elektrolit dengan cara dialisis, yakni pemurnian medium pendispersi dari elektrolit.
|
Koloid Liofil
|
Koloid Liofob
|
|
|








Tidak ada komentar:
Posting Komentar